Finalmente, dopo tanto tempo, sembra che un nuovo passo avanti nella lotta alla malattia di Alzheimer sia imminente, sebbene lungi dall’essere definitivo.
Questo progresso è rappresentato dai nuovi anticorpi monoclonali (*) diretti contro una delle sostanze coinvolte nella malattia: la β-amiloide. Già nel 2021, la FDA (Food and Drug Administration), l’Agenzia del Farmaco americana, aveva approvato il primo anticorpo monoclonale attivo in tal senso, denominato Aducanumab (nome commerciale ADUHELM). Tuttavia, dopo un certo periodo, l’azienda che aveva sviluppato il farmaco, la Biogen, ha deciso di disinvestire su questo medicinale, che durante gli studi clinici aveva dato risultati controversi, bloccandone di fatto la produzione, e di concentrarsi invece su un nuovo farmaco, sempre mirato contro β-amiloide, chiamato Lecanemab, sviluppato in collaborazione con l’azienda Eisai. Anche Lecanemab ha ottenuto l’approvazione da parte della FDA.
Successivamente ad Aducanumab e Lecanemab, è stato messo a punto un terzo anticorpo monoclonale anti amiloide, chiamato Donanemab, che ha mostrato risultati simili a quelli di Lecanemab e che pure ha ricevuto l’approvazione da parte di FDA.
Nessuno di questi farmaci è stato al momento approvato dall’EMA (European Medicines Agency), l’Agenzia del Farmaco europea, ma è noto che anche l’EMA stia valutando attentamente i risultati di questi anticorpi monoclonali e non è escluso che possa dare il via libera, seguendo l’esempio dell’omologa agenzia statunitense. Restiamo in attesa di sviluppi futuri.
Ad ogni modo, va accolta con cauta speranza la notizia che si torni a parlare della possibilità di avere nuove medicine contro questa terribile malattia, sia perché l’ultima volta che è stato immesso in commercio un farmaco contro l’Alzheimer risale al lontano 2003 ma anche, e soprattutto, perché i farmaci oggi a disposizione offrono risultati in genere modesti e poco duraturi.
Il dato però in assoluto più rilevante è che, per la prima volta, si parli di farmaci capaci di modificare il decorso della malattia (disease modifying), differentemente dai farmaci attualmente in commercio che sono solamente farmaci sintomatici, cioè che si limitano a ridurre i sintomi, senza interferire con il processo biologico causante la patologia. Questi anticorpi monoclonali invece sono in grado di interferire con la malattia dal punto di vista biologico andando ad agire contro la sostanza, o per meglio dire una delle sostanze, che si ritiene essere implicata nella malattia di Alzheimer.
Entriamo ora nel dettaglio della malattia per poi descrivere le evidenze a sostegno dell’uso di queste nuove medicine.
CHE COS’È LA MALATTIA DI ALZHEIMER
Prima di addentrarci nella storia degli anticorpi anti-amiloide, è bene qui ricordare brevemente che cosa sia la malattia di Alzheimer e perché abbiamo un disperato bisogno di medicine efficaci contro questa patologia. Cominciamo col dire che la malattia di Alzheimer andrebbe più correttamente chiamata di Alzheimer-Perusini, visto il ruolo fondamentale che ha avuto nel suo inquadramento il grandissimo, e ahimè poco noto, scienziato italiano Gaetano Perusini, ma per semplicità la chiameremo qui solamente malattia di Alzheimer.
L’Alzheimer è una malattia neurologica molto diffusa nel mondo occidentale ed è caratterizzata, tra le altre cose, dall’accumulo nel cervello di due sostanze: la proteina β-amiloide e la proteina tau.

Secondo l’ipotesi ancora oggi più accreditata (che pure non tutti gli esperti condividono), l’accumulo anomalo di queste due proteine nel cervello è in grado di innescare un lentissimo ma inesorabile processo neurodegenerativo che uccide progressivamente i neu-roni (cioè le cellule del cervello).
Questo processo per molto tempo (anche decenni) non dà segno di sé per cui il paziente resta completamente asintomatico, conduce una vita normale e non ha problemi cognitivi, anche se il suo cervello sta progressivamente degenerando.
Dopo un periodo di tempo variabile, il danno neurodegenerativo inizia a manifestarsi sul piano clinico con un deterioramento cognitivo che, all’inizio, è molto lieve, ma via via tende sempre più ad aggravarsi tanto da condurre progressivamente ad una condizione di demenza conclamata, ovvero alla completa dipendenza dagli altri, quindi all’allettamento completo ed infine alla morte.
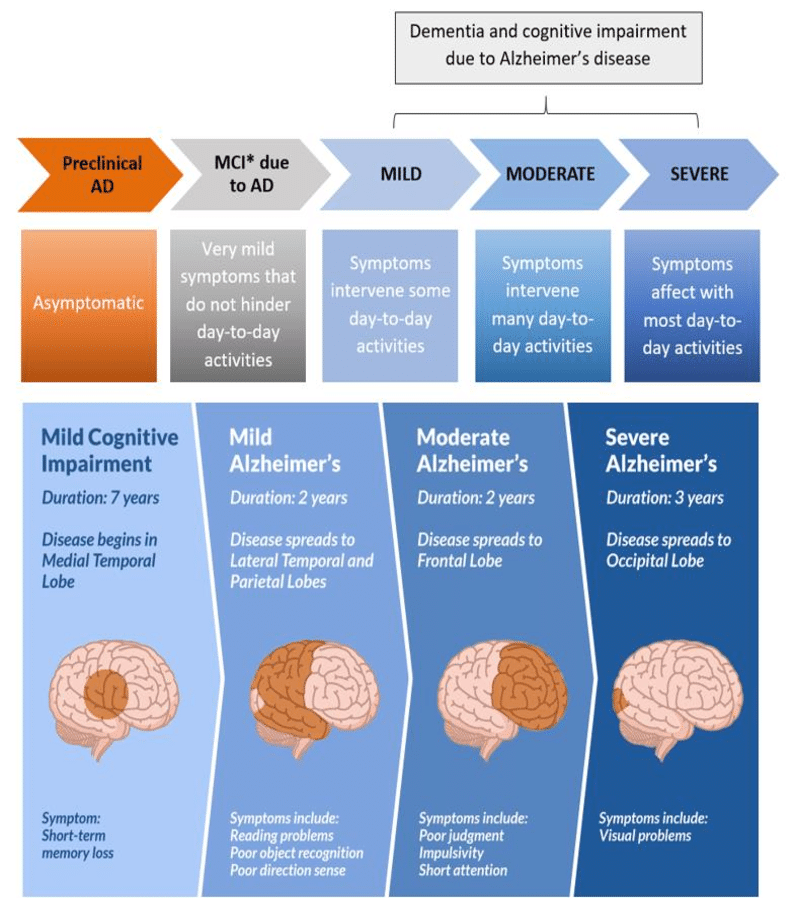
È perciò possibile dividere la storia della malattia di Alzheimer in tre grandi fasi:
1) fase asintomatica,
2) fase di declino cognitivo lieve chiamata dagli autori anglosassoni MCI (Mild Cognitive Impairment) e
3) fase di demenza.
La differenza sostanziale tra MCI e demenza è che nella fase di MCI il paziente presenta sì dei disturbi cognitivi (tipicamente, ma non sempre, disturbi di memoria), ma resta sostanzialmente autonomo nelle attività della vita quotidiana, mentre nella fase di demenza (che oggi andrebbe più correttamente chiamata disturbo neurocognitivo maggiore) il paziente, a causa dei suoi problemi cognitivi, ha bisogno dell’aiuto di altre persone per poter vivere.
Quando il paziente presenta una demenza grave non è in grado di svolgere alcune delle abituali attività quotidiane in maniera autonoma e senza assistenza: non controlla gli sfinteri e spesso non deglutisce bene il cibo. Nel giro di qualche anno, il paziente perde completamente la capacità di parlare e di interagire con l’ambiente fino a non riuscire più nemmeno a muoversi.
Ecco quindi l’allettamento obbligato dalle condizioni cliniche a cui segue, dopo un certo periodo di tempo, il decesso (generalmente per complicanze, tipicamente infettive, legate appunto all’allettamento progressivo).
QUANTO È DIFFUSO L’ALZHEIMER
La malattia di Alzheimer è la più frequente malattia neurodegenerativa nel mondo occidentale e la più frequente causa di demenza nell’anziano, riguardando il 50-70% dei casi di demenza. Rappresenta, inoltre, una delle condizioni più gravemente disabilitanti in età avanzata. Attualmente in Italia si stima siano colpiti da questa malattia tra 600.000 e 1 milione di persone, mentre nel mondo sembra ne siano affette circa 50 milioni di persone.
Si stima che, in virtù dell’aumento dell’aspettativa di vita a livello mondiale, la sua diffusione globale triplicherà entro il 2050, quando ne risulteranno affette ben 150 milioni di persone.

LE TERAPIE DISPONIBILI PRIMA DEGLI ANTICORPI MONOCLONALI
Fino ad oggi avevamo a disposizione solo quattro farmaci contro i sintomi dell’Alzheimer: tre molto simili tra loro (galantamina, rivastigmina e donepezil) e uno, l’ultimo arrivato nel 2003, con un meccanismo d’azione un po’ diverso, chiamato memantina.
Senza addentrarci nei dettagli, è sufficiente qui ribadire che questi farmaci non curano la malattia, ma vanno ad attenuarne i sintomi e, come già accennato, il loro effetto, quando presente, tende a perdersi rapidamente. Questo è il motivo per cui oggi la ricerca non punta più solo a medicine che riducano i sintomi, ma si indirizza verso molecole in grado di interferire con i meccanismi neurodegenerativi che si pensa causino la patologia, in primis l’accumulo progressivo di β-amiloide.
IL PRIMO ANTICORPO ANTI-AMILOIDE ARRIVATO SUL MERCATO: ADUCANUMAB
Come già accennato in premessa, il primo farmaco anti-amiloide approvato per il mercato americano è stato Aducanumab (in precedenza erano stati testati altri anticorpi monoclonali, ma tutti con esito negativo). Come tutti i farmaci, prima della commercializzazione, ha attraversato le varie fasi di sperimentazione preclinica (laboratorio, in vitro e poi su animali) e clinica nell’uomo.
Dopo la fase I (volontari sani) e la fase II (persone malate) volte a valutare soprattutto la sicurezza del medicinale, l’ultima fase di sperimentazione clinica è la cosiddetta fase III, in cui viene arruolato un numero abbastanza grande di persone malate in modo da permettere ai ricercatori di valutare, con sufficiente accuratezza, l’efficacia del farmaco nelle condizioni sperimentali (Fig. 1).
I pazienti arruolati vengono divisi a caso in due gruppi: ad un gruppo viene somministrato il farmaco e ad un secondo gruppo un prodotto inerte, cioè il placebo (o, in altri casi, un farmaco già in commercio come confronto). Per evitare condizionamenti, né il paziente né il medico sperimentatore sanno se la singola persona arruolata sia assegnata al gruppo farmaco o al gruppo placebo (tecnicamente si dice che la sperimentazione è condotta in doppio cieco).
Alla fine della sperimentazione, applicando analisi statistico-matematiche, si verificano i dati confrontando l’andamento clinico delle persone nei due gruppi di trattamento; qualora il farmaco risulti più efficace del placebo (o del medicinale di confronto), si va poi a stimare, con opportuni esami statistici, quanto sia probabile che differenze uguali o maggiori di quelle eventualmente osservate possano essere prodotte dal puro caso (e non dal farmaco). Qualora questa probabilità sia sufficientemente bassa (in genere, per convenzione minore del 5%), si dice che la differenza a favore del farmaco sperimentale sia statisticamente significativa (che però non sempre vuol dire clinicamente rilevante, ma questo è un altro discorso che qui non affronteremo).
Nel caso di Aducanumab, sono stati condotti due studi di fase III (tecnicamente chiamati trial randomizzati controllati in doppio cieco) di eguali dimensioni, che sono stati chiamati EMERGE ed ENGAGE 1.
In ambedue questi trial, sono state arruolate 1.350 persone con malattia di Alzheimer in fase di MCI o in fase di demenza lieve (sono stati quindi esclusi i pazienti con malattia in fase molto avanzata). L’obiettivo primario dello studio era valutare se il farmaco, utilizzato nella sperimentazioni a vari dosaggi, riducesse, rispetto al placebo, la velocità del declino cognitivo misurato con opportuni strumenti neuropsicologici. Tra gli obiettivi secondari dello studio c’erano:
- rivalutare ulteriormente su numeri più grandi la sicurezza del farmaco (ovvero quantificare i rischi di effetti collaterali rispetto al placebo) già misurata nelle fasi precedenti di sperimentazione, e
- andare a vedere quanto il farmaco fosse in grado di “ripulire” il cervello dei pazienti dalla sostanza β-amiloide.
Prima di iniziare lo studio, tutti i pazienti venivano sottoposti ad una valutazione neuropsicologica per verificarne il grado di malattia ed escludere quelli con malattia più grave.
Le persone, inoltre, venivano sottoposte ad un esame molto complesso, chiamato PET-amiloide: la Tomografia ad Emissione di Positroni (PET) è una tecnica diagnostica ad immagini che utilizza una sostanza radioattiva, detta radiotracciante, per rilevare cambiamenti fisiologici e biochimici in un organo. Il radiotracciante viene somministrato endovena al paziente, arriva quindi nel cervello e, in presenza di β-amiloide, si va a legare ad essa così evidenziandola.
Grazie a questo esame riusciamo quindi a leggere il segnale specifico dato dal legame del radiotracciante con la β-amiloide: se il segnale c’è, vuol dire che la β-amiloide è presente nel cervello, se non c’è vuol dire che la β-amiloide è assente e, di conseguenza, dato che se non c’è β-amiloide non c’è per definizione l’Alzheimer, in caso di mancato segnale, possiamo ragionevolmente escludere (salvo casi rari di falsi negativi) che la causa del declino cognitivo presentato dalla persona che abbiamo di fronte sia la malattia di Alzheimer.
Tornando al trial, tutti i soggetti con MCI o demenza lieve, PET amiloide positiva e che non presentavano i criteri di esclusione previsti dal protocollo, potevano essere arruolati e casualmente assegnati o al gruppo farmaco (testato in 3 diversi dosaggi) o al gruppo placebo.
Durante la sperimentazione, tutti i pazienti venivano regolarmente valutati sul piano neuropsicologico e con PET-amiloide di controllo in modo da valutare le eventuali modifiche sia cliniche che neurobiologiche.
Purtroppo, a marzo 2019, l’analisi fatta in corso d’opera sui dati a disposizione (tecnicamente chiamata interim analysis) diede esito negativo (leggasi il farmaco non dava miglioramento rispetto al placebo, quindi in soldoni, il farmaco non funziona) e i due trial (EMERGE ed ENGAGE) furono precocemente interrotti.

A distanza di qualche mese, ad ottobre 2019, ecco un colpo di scena: una nuova e più approfondita analisi dei dati condotta da Biogen rivelò qualcosa di interessante.
Nel trial EMERGE il farmaco, se somministrato al dosaggio maggiore, aveva raggiunto l’obiettivo primario, ovvero era risultato in grado di rallentare il declino cognitivo di circa il 30 per cento rispetto al placebo. Al contrario, nel trial ENGAGE l’esito si confermò negativo, ovvero il farmaco non aveva raggiunto l’obiettivo primario.
In tutti e due i trial, il farmaco era poi risultato in grado di ridurre l’accumulo di β-amiloide nel cervello in misura dose-dipendente. Quanto agli effetti collaterali, questi erano risultati globalmente lievi e di norma reversibili.
In relazione all’efficacia clinica, che era l’obiettivo primario, questa rianalisi dei dati aveva quindi prodotto risultati controversi, poiché un trial era risultato positivo e uno negativo.
Gli scienziati procedettero ad un’ulteriore analisi, tecnicamente chiamata post-hoc analysis, per cercare la ragione di queste differenze.
È emerso quindi che, per motivi a tutt’oggi non chiari, ma verosimilmente legati all’estrema variabilità clinica dell’Alzheimer, nel trial EMERGE (quello con risultati positivi) i pazienti trattati con placebo avevano avuto un declino cognitivo significativamente più spiccato dei pazienti trattati con placebo nel trial ENGAGE (quello con esito negativo).
Questo diverso comportamento clinico delle persone del gruppo placebo potrebbe già di per sé spiegare le differenze osservate nei due studi.
Inoltre, facendo una sotto analisi del trial ENGAGE relativa ai pazienti trattati con dosaggio più alto e per un tempo maggiore, sembrava intravedersi un trend a vantaggio del farmaco anche in questo studio che pure era risultato globalmente negativo.
Sulla base di questi dati e considerando che la malattia di Alzheimer era una malattia orfana di trattamento disease-modifying, l’azienda BIOGEN richiedeva l’autorizzazione a FDA per l’immissione in commercio del farmaco.
Nonostante due pareri negativi da parte di una commissione interna ad FDA e specializzata sui farmaci attivi sul sistema nervoso centrale, l’FDA nel suo complesso a giugno 2021 dava parere favorevole, richiedendo però all’azienda Biogen di effettuare uno studio di fase IV (cosiddetto post- commercializzazione) per rivalutare ulteriormente l’efficacia del medicinale.
L’EMA, al contrario, non ha mai concesso parere favorevole a questo farmaco.
IL SECONDO E IL TERZO ANTICORPO ANTI-AMILOIDE: LECANEMAB E DONANEMAB
Arriviamo a novembre 2022 e sul New England Journal of Medicine viene pubblicato un trial randomizzato controllato contro placebo che ha coinvolto 1.795 persone, in cui è stato sperimentato un altro anticorpo monoclonale anti amiloide chiamato Lecanemab, nato dalla partnership tra EISAI e ancora Biogen 2.
In questo studio, i pazienti tra 50 e 90 anni, con MCI o demenza lieve e PET amiloide positiva, sono stati randomizzati a caso per ricevere o il farmaco o il placebo. L’obiettivo primario era l’efficacia nella riduzione del declino cognitivo dopo 18 mesi di trattamento.
Alla fine dello studio è stato riscontrato un rallentamento di circa il 30% nella velocità del declino cognitivo nei pazienti che avevano assunto il farmaco rispetto a quelli che avevano assunto il placebo. In altre parole, anche assumendo il farmaco i pazienti peggioravano, ma un po’ più lentamente che senza di esso.
Anche questo farmaco, come Aducanumab, ha dimostrato alla PET di ridurre i depositi di amiloide nel cervello.
Quanto tutto questo si traduca in un miglioramento a lungo termine della qualità della vita dei pazienti (e dei familiari) non è ancora chiaro, proprio perché lo studio è durato solamente 18 mesi.
Dal punto di vista della sicurezza, il farmaco è stato giudicato globalmente sicuro, anche se alcuni effetti avversi rilevanti sono stati segnalati, quali emorragie cerebrali (in genere piccole e di scarso significato clinico ma qualche volta anche gravi), confusione, cefalea e crisi epilettiche. Tali effetti sono risultati in genere associati allo sviluppo di lesioni cerebrali visibili alla risonanza magnetica, chiamate ARIA (Amyloid-Related Imaging Abnormalities). FDA, comunque, soppesando rischi e benefici del farmaco, ha dato piena approvazione; EMA invece per il momento no.
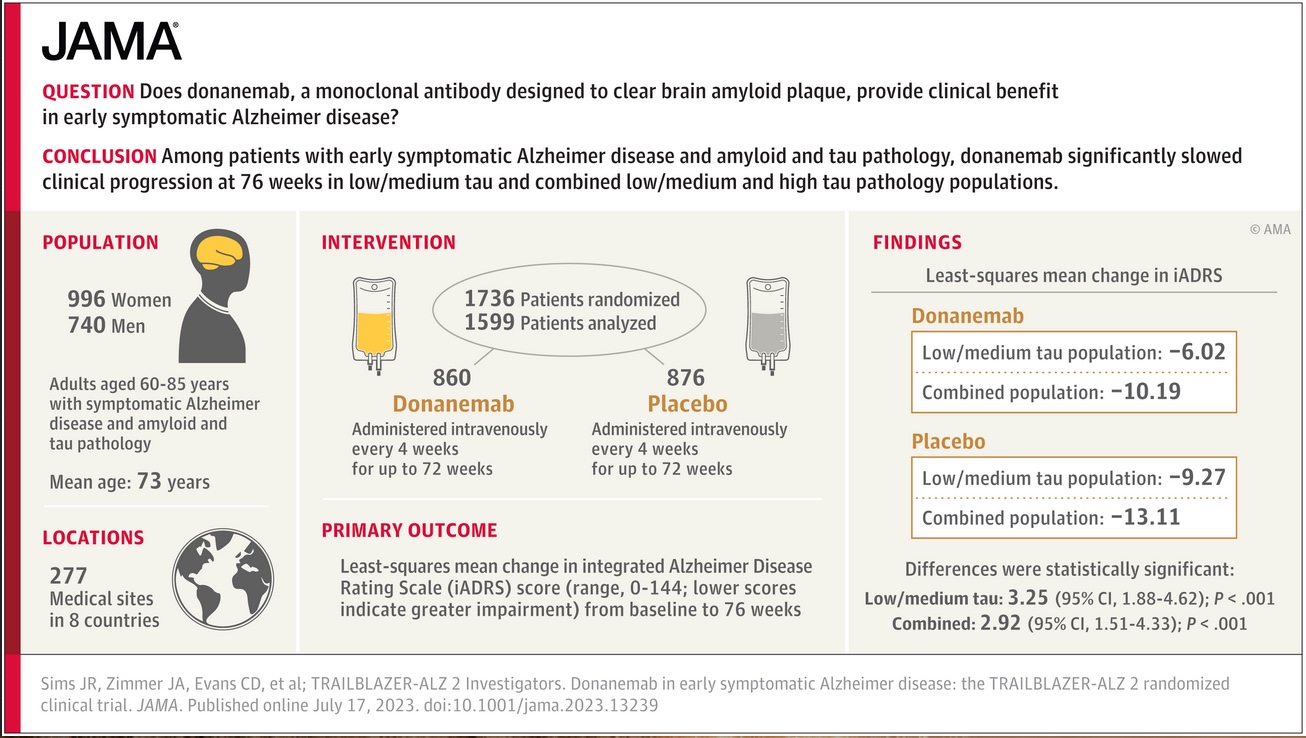
Risultati simili a quelli di Lecanemab, sia dal punto di vista dell’efficacia che della sicurezza, sono stati ottenuti con un altro farmaco anti amilode, il Donanemab, messo a punto dall’azienda Ely Lilli; anch’esso è stato testato in un trial randomizzato controllato contro placebo i cui risultati sono stati recentemente pubblicati sul Journal of Medical Association (JAMA) 3.
Per quanto confronti indiretti tra studi diversi siano sempre da fare con massima cautela e per quanto le popolazioni incluse negli studi che hanno messo alla prova i due farmaci non siano completamente sovrapponibili, anche per Donanemab, come per Lecanemab, i principali effetti avversi sono risultati legati allo sviluppo di ARIA (con conseguente danno emorragico o da edema); per quanti riguarda l’efficacia, anche per Donanemab i dati suggeriscono una riduzione di circa il 30% della velocità del declino cognitivo rispetto al placebo in un follow- up di 18 mesi.
Anche in questo caso, ancora nulla si può dire sull’impatto a lungo termine del farmaco e non sappiamo quali sottogruppi di pazienti ne beneficiano potenzialmente di più, anche se da prime analisi pare che il massimo vantaggio si ottenga con il trattamento precoce.
CONCLUSIONI
Al momento nessuno di questi farmaci è disponibile nel nostro Paese, ma non è escluso che lo saranno nei prossimi mesi. Probabilmente potranno dare un contributo nella lotta alla malattia di Alzheimer, specie se usati nelle fasi precoci, ma molto difficilmente rappresenteranno la soluzione finale.
Diverse questioni potrebbero ostacolare l’effettivo uso di questi farmaci: problemi di natura organizzativa, ad esempio la disponibilità di apparecchiature PET negli ospedali necessarie per individuare quali pazienti siano potenzialmente candidabili a queste terapie, e dubbi sulle modalità corrette di gestione dei possibili effetti avversi di questi farmaci che pure, al momento, appaiono globalmente alquanto sicuri. i
In definitiva, siamo ancora purtroppo lontani dall’aver sconfitto definitivamente la malattia di Alzheimer, ma un cauto ottimismo per il futuro ce lo possiamo concedere.
Nota
*Gli anticorpi monoclonali sono proteine artificiali progettate per legarsi in modo mirato e specifico ad antigeni, cioè molecole estranee o difettose, nel corpo umano.
Sono prodotti in laboratorio partendo da un unico tipo di cellula immunitaria (linfocita B) ed essendo, quindi, tutti identici si definiscono “monoclonali”.
Sono utilizzati come terapia in oncologia, nelle malattie autoimmuni, infezioni, malattie degenerative e altre condizioni patologiche e comunque ovunque ci sia il bisogno di legare specificamente una molecola.
BIBLIOGRAFIA
- Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer’s Disease | The Journal of Prevention of Alzheimer’s Disease (springer.com)
- Lecanemab in Early Alzheimer’s Disease (nejm.org)
- Donanemab in Early Symptomatic Alzheimer Disease: The TRAILBLAZER-ALZ 2 Randomized Clinical Trial | Dementia and Cognitive Impairment | JAMA | JAMA Network
Crediti fotografici:
dott. Francesco Carracchia